Prognozējiet Al jonu lādiņu kā profesionālis—un atklājiet galvenos izņēmumus

Sāciet ar Al jonu lādiņa nozīmi
Ko nozīmē Al jonu lādiņš vienkāršos vārdos
Vai jūs kad domājāt, kāpēc alumīnijs savienojumos gandrīz vienmēr parādās kā Al 3+? Jēdziena al jonu lādiņš ir vienkāršs, bet spēcīgs: tas norāda, cik elektronu alumīnija atoms ir zaudējis vai ieguvis, lai izveidotu stabilu jonu. Alumīnijam visizplatītākais un uzticamais lādiņš ir +3. Tas nozīmē, ka katrs alumīnija jons ir zaudējis trīs elektronus, veidojot kationu ar 3+ lādiņu. Tāpēc, kad jūs redzat terminu alumīnija lādiņš vai alumīnija lādiņš ķīmijā, tas gandrīz vienmēr attiecas uz Al 3+.
Kur Al atrodas periodu tabulas lādiņos un kāpēc tas ir svarīgi
Kad skatāties uz periodiskā tabula ar jonu lādiņiem , jūs pamanīsit, ka vienā grupā esoši elementi bieži veido jonus ar vienādu lādiņu. Alumīnijs atrodas 13. grupā (reizēm to sauc par IIIA grupu), tieši pēc magnija un pirms silīcija. Tendence? Galveno grupu metāli mēdz zaudēt elektronus, lai sasniegtu tuvākā nobāzē esošo gāzi elektronu skaitu. Alumīnijam tas nozīmē trīs elektronu zaudēšanu — tādējādi radot +3 lādiņu. Šis grupas pamatā izveidotais modelis ir īss veids, kā prognozēt lādiņus, nevis iemācīties katru elementu atsevišķi. Piemēram, 1. grupas metāli vienmēr veido +1 jonus, 2. grupas metāli veido +2, bet 13. grupa — ieskaitot alumīniju — veido +3 jonus. Tas ir pamats daudziem periodiskās tabulas lādiņi pēc grupām atsauces tabulām.
| Grupa | Tipisks lādiņš |
|---|---|
| 1 (Lūžņu metāli) | +1 |
| 2 (Zemes sārmu metāli) | +2 |
| 13 (Alumīnija grupa) | +3 |
| 16 (Chalkogēni) | −2 |
| 17 (halogēni) | −1 |
Ātri pārbaudījumi, lai apstiprinātu Al 3+parastajos savienojumos
Iedomājieties, ka strādājat ar Al 2O 3(alumīnija oksīds) vai AlCl 3(alumīnija hlorīds). Kā zināt, ka alumīnijs ir +3? Viss ir saistīts ar lādiņu līdzsvarošanu. Skābeklis parasti ir ar −2 lādiņu, bet hlorīdam ir −1 lādiņš. Al 2O 3, divi Al 3+joni (kopā +6) līdzsvaro trīs O 2−joni (kopā −6). AlCl 3, viens Al 3+ions līdzsvaro trīs Cl −joni (kopā −3). Šie modeļi padara vieglu atrašanu un apstiprināšanu al apmērs reālos savienojumos.
- Al 3+veidojas, zaudējot trīs elektronus, pielāgojoties tuvākā nobālā gāzes konfigurācijai.
- Tas ir vienīgais parastais stabils ions alumīnijam, kas padara prognozēšanu vienkāršu.
- Grupas tendences periodiskajā tabulā palīdz ātri identificēt Al 3+bez mechaniskas iegaumēšanas.
Galvenais secinājums: Alumīnijam ir priekšroka +3 lādiņam, jo šis stāvoklis tam nodrošina stabila, nobālās gāzes veida elektronu konfigurāciju—padarot Al 3+par galveno jonu liumos savienojumos.
Izprotot šīs tendences un to, kā periodiskās tabulas lādiņi darbs, jūs varēsiet paredzēt al jonu lādiņš un tā partnerība savienojumos ar pārliecību. Nākamajās sadaļās jūs redzēsiet, kā šīs zināšanas saistītas ar ūdens ķīmiju, nosaukšanas konvencijām un pat reālās pasaules materiālu veiktspēju.
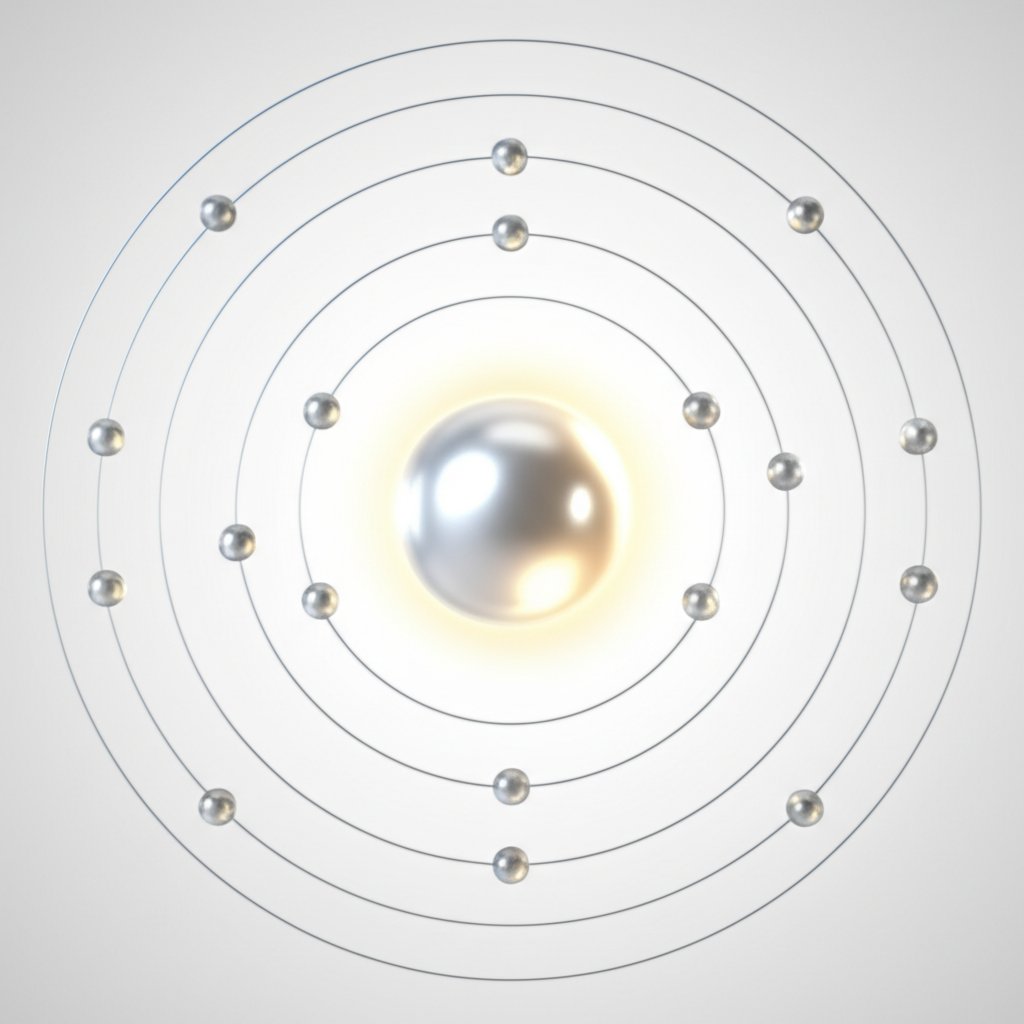
Elektronu konfigurācija, kas noved pie Al3 pluss
Al vērtības elektroni un ceļš uz Al3+
Kad jūs pirmo reizi skatāties uz alumīnija atomu, ceļš uz tā tipisko +3 lādiņu var šķist mīklains. Taču, ja to izanalizē pēc elektronu konfigurācijas, loģika ātri kļūst skaidra. Alumīnijam ir atomskaitlis 13, kas nozīmē, ka tas satur 13 elektronus, kad tas ir neitrāls. Tā elektronu konfigurāciju raksta kā 1s 22s 22P 63S 23P 1, vai kompaktāk, [Ne] 3s 23P 1. Trīs elektroni 3s un 3p orbitālēs tiek uzskatīti par alumīnija vērtības elektroniem – tie ir tie, kas visvairāk var tikt zaudēti ķīmiskās reakcijās.
Pakāpeniska elektronu noņemšana no 3p, pēc tam 3s
Šķiet sarežģīti? Iedomājieties, ka noņemat kārtas: ārējie elektroni ir vieglāk noņemami. Tā aluminum veido jonu ar lādiņu +3:
- Noņemiet 3p elektronu: Vienīgais elektrons 3p orbitālē tiek zaudēts vispirms, atstājot [Ne] 3s 2.
- Noņemiet divus 3s elektronus: Tālāk tiek noņemti abi elektroni 3s orbitālē, rezultātā iegūstot [Ne].
- Rezultāts: Alumīnija atoms tagad ir zaudējis kopumā trīs elektronus, veidojot Al 3+jonu, kura konfigurācija sakrīt ar neona—retā gāze—konfigurāciju.
- Neitralizēts alumīnijs: [Ne] 3s 23P 1
- Zaudējot vienu elektronu: [Ne] 3s 2
- Zaudējot vēl divus elektronus: [Ne]
Šo posmu procesu virza vēlme pēc stabilitātes. alumīnija vērtība ir 3, atspoguļojot trīs elektronus, kurus tas parasti zaudē, lai sasniegtu retgāzes konfigurāciju. Kad alumīnijs veido jonu ar 10 elektroniem, tas ir zaudējis trīs elektronus un kļūst par Al 3+ (atsauce) .
Kāpēc +3, nevis +1 alumīnijam
Kāpēc alumīnijs neapstājas pie +1 vai +2? Atbilde slēpjas efektīvajā kodola lādiņā un apvalka stabilitātē. Zaudējot visus trīs vērtības elektronus, alumīnija jona lādiņš sasniedz pilnībā aizpildītu apvalku konfigurāciju — atbilstošu neona stabilitātei. Apstāšanās pie +1 vai +2 atstātu daļēji aizpildītus apvalkus, kas ir mazāk stabili, jo elektronu sadalījums ir nevienmērīgs un vājāks ir aizsardzības efekts. Tāpēc alumīnija jona lādiņš ir gandrīz vienmēr +3 savienojumos.
Tieksme sasniegt pilnībā aizpildītu apvalku, retgāzes konfigurāciju, liek Al 3+pārsvarā vēlamais stāvoklis ķīmijā alumīnija joniem.
Šo elektronu izmaiņu izpratne palīdz jums prognozēt un izskaidrot elektronu alumīnijam dažādos kontekstos. Tālāk redzēsit, kā šie modeļi ļauj ātri prognozēt lādiņus alumīnijam un tās periodiskās tabulas kaimiņiem — un pamanīt izņēmumus, kad tie rodas.
Jonu lādiņu prognozēšana un izņēmumu apstrāde
Lādiņu prognozēšana pēc periodiskiem modeļiem ātri
Kad skatāties uz periodiskā tabula ar lādiņiem , jūs pamanīsit noderīgu modeli: vienā grupā (vertikālā kolonnā) esošie elementi parasti veido jonus ar vienādu lādiņu. Tādējādi jonu periodiskā tabula spēcīgs īsceļš, lai paredzētu iespējamo jonu lādiņu vairumam elementu—īpaši galvenajai elementu grupai.
| Grupa | Tipisks jonu lādiņš |
|---|---|
| 1 (Lūžņu metāli) | +1 |
| 2 (Zemes sārmu metāli) | +2 |
| 13 (Bora grupa, ieskaitot Al) | +3 |
| 16 (Chalkogēni) | −2 |
| 17 (halogēni) | −1 |
Piemēram, 13. grupas lādiņš gandrīz vienmēr ir +3, tāpēc alumīnijs vienmēr veido Al 3+jonus. Šis raksts atkārtojas visā lādiņu periodiskajā tabulā —1. grupas elementi veido +1, 2. grupas veido +2 utt. Kad jums jāzina kāds ir Al lādiņš , jūs varat ātri atsaukties uz tā grupas pozīciju un droši paredzēt +3 (atsauce) .
Kad izņēmumi kā Tl +pārspēko vienkāršus noteikumus
Bet kā tad ar izņēmumiem? Lai arī lielākā daļa galveno grupu elementu seko šiem tendencēm, ir daži pārsteigumi — īpaši, pārvietojoties uz leju grupā. Ņemiet talijs (Tl) 13. grupā: lai gan 13. grupas lādiņš parasti ir +3, talijs bieži veido Tl +jonus. Kāpēc? Tāpēc, ka pastāv inertā pāra efekts , kur zemākas enerģijas s-elektroni ir mazāk iespējams, ka tie iesaistīsies saistē, jo atomi kļūst smagāki. Rezultātā talijs var "turēt" savus s-elektronus, padarot +1 stāvokli daudz stabilāku nekā +3 daudzās savienojumos. Šis izņēmums mums atgādina, ka nevajag akli paļauties uz grupas tendencēm, strādājot ar smagākiem elementiem.
Kā rīkoties ar mainīgajiem pārejas metālu lādiņiem
Pārejas metāli, kas atrodas centrālajā daļā periodiskās tabulas un lādiņu diagrammas ir slaveni ar savu neprognozējamību. Saskaņā ar galvenajām grupām metāliem, tie var veidot jonus ar vairākiem iespējamiem lādiņiem — domājiet Fe 2+un Fe 3+, vai Cu +un Cu 2+. Šī mainīguma dēļ jums vienmēr jāpārbauda atsauce vai savienojuma konteksts, strādājot ar pārejas metalloīdiem. Neuzskatiet lādiņu tikai pēc grupas atrašanās vietas.
- Identificējiet elementa grupu: Izmantojiet periodisko tabulu, lai atrastu grupas numuru.
- Lietojiet grupas tendenci: Prognozējiet tipisko lādiņu, pamatojoties uz grupu (skatīt tabulu augšā).
- Pārbaudiet izņēmumus: Smagākiem p-bloka elementiem (piemēram, Tl) vai pārejas metalloīdiem apskatiet uzticamu atsauces materiālu.
Alumīnija pastāvīgais +3 lādiņš ir daudz prognozējamāks nekā pārejas metālos sastopamie mainīgie lādiņi – tādējādi to veicīgi izmantojot, balansējot jonu savienojumus.
Apguvot šos modeļus un atpazīstot izņēmumus, jūs varēsiet izmantot lādiņus no periodiskās tabulas kā ātru un efektīvu rīku formulu veidošanai un pārbaudei. Tālāk jūs redzēsiet, kā šie paredzējumi saistīti ar alumīnija jonu reālās uzvedības ūdenī un vēl tālāk.
Al3 ūdens ķīmija +Un hidrolīze
Heksaakva Al 3+un hidrolīzes secība
Kad jūs izšķīdināt alumīnija sāli, piemēram, Al(NO 3)3ūdenī, jūs neatbrīvojat tikai vienkāršus Al 3+jonus. Tā vietā, to apņem alumīnija kationu tūlīt piesaistīt un saites uz sešiem ūdens molekulām, veidojot stabilu hexaaqua komplekss [Al(H 2O) 6]3+- Jā. Šis jons ir oktaēdrais, ar koordinācijas skaitli 6a, kas ir kopīgs raksturlielums alumīnija jonus ūdens vidē (atsauce) .
Taču stāsts nepierina ar to. Augsta Al pozitīvais slāpeklis 3+tas padara to par spēcīgu Leivisa skābi, kas izņem elektronus no koordinētām ūdens molekulām. Tā rezultātā šie ūdens ligandi kļūst skābeski un pH pieauguma gaitā pakāpeniski var zaudēt protonus. Šis process ir hidrolīze izveido jaunu jonu sēriju, kā parādīts turpmāk:
- Zemu pH temperatūrā: [Al(H 2O) 6]3+dominē.
- Tā kā pH līmenis pieaug: Vienas ūdens liganda zaudē protonu, veidojot [Al(H 2O) 5(OH)] 2+.
- Turpmāka deprotonēšana rada [Al(H 2O) 4(OH) 2]+.
- Beidzot, neitrāls Al(OH) 3(alumīnija hidroksīds) izgulsnējas.
- Augstā pH vērtībā: Al(OH) 4−(alumināta jons) veidojas un atkal izšķīst.
Šī secība ir klasisks piemērs tam, kā kationi un anioni ūdenī mijiedarbojas un kāpēc hidroksīda lādiņš ir tik svarīgs, lai noteiktu, kuras sugas ir klāt pie noteikta pH (avots) .
Amfotērisms un ceļš uz alumīnātu
Šeit lietas kļūst interesantas: Al(OH) 3ir amfoterisks . Tas nozīmē, ka tas var reaģēt gan ar skābēm, gan bāzēm. Skābās šķīdumos tas izšķīst, lai atkal veidotu Al 3+(vai tā hidratētās formas). Bāziskos šķīdumos tas turpina reaģēt, veidojot šķīstošu alumīnāta jonu, Al(OH) 4−. Šāda divkāršā uzvedība ir raksturīga daudziem alumīnija jonus un ir būtiski, lai izprastu to šķīdību un nogulsnēšanos dažādās vidēs.
-
Parasti Al ligandi 3+:
- Ūdens (H 2O)
- Hidroksīds (OH −)
- Ftorīds (F −)
- Sulfāts (SO 42−)
- Organiskās skābes (piemēram, citrāts vai oksalāts)
Šī iemesla dēļ alumīnijs ir tik daudzpusīgs ūdens attīrīšanā, krāsošanā un pat kā koagulants – spēja pārslēgties starp dažādām formām atkarībā no pH līmeņa ir tā ķīmijas pamats.
Kāds Al 3+Lādiņš nozīmē šķīdībai
Tātad, ko tas viss nozīmē šķīdībai alumīnija jonu savienojumiem? Neitrālos līdz viegli bāziskos apstākļos Al(OH) 3tam ir ļoti zema šķīdība un izgulsnējas – tā ir pamats alumīnija noņemšanai no ūdens. Tomēr stipri skābos vai stipri bāziskos apstākļos alumīnijs paliek izšķīdis vai nu kā [Al(H 2O) 6]3+vai Al(OH) 4−. Šāda anfotēriskā uzvedība ir iemesls, kādēļ alumīnija kationu ķīmija ir ļoti svarīga vides un rūpniecisko procesu kontekstā.
Al lielā lādiņa blīvums 3+to padara par spēcīgu Lūisskābi, kas veicina pakāpenisku hidrolīzi un dažādu alumīnija jonu veidošanos šķīdumā.
Šo pārvērtību izpratne ļauj jums paredzēt ne tikai to, alumīnija jonus kuri ir klātesoši dažādos pH līmeņos, bet arī to, kā kontrolēt to izgulsnēšanos, šķīdību un reaktivitāti. Nākamajā sadaļā jūs redzēsiet, kā šie šķīdumu īpašības tieši saistītas ar nosaukšanas noteikumiem un formulu modeļiem alumīnija savienojumiem praktiskos apstākļos.
Nosaukšanas noteikumi un formulu modeļi alumīnijam
Alumīnija savienojumu pareiza nosaukšana
Kad redzat Al 3+savienojumā, tā nosaukšana ir atsvaidzinoši vienkārša. Alumīnija jona nosaukums ir vienkārši „alumīnija jons”, jo jonu savienojumos tas veido tikai vienu parasto lādiņu. Nav nepieciešama nejednozība vai papildu apzīmējumi — ja vien jūs nepievēršaties stilam, kas pirms skaitļiem izmanto romiešu ciparus skaidrības labad. Piemēram, gan „alumīnija hlorīds”, gan „alumīnija(III) hlorīds” ir pieņemami, taču romiešu cipars ir neobligāts, jo alumīnija lādiņš šādos kontekstos vienmēr ir +3.
Al izlīdzināšana 3+ar kopīgiem anjoniem
Formulu rakstīšana savienojumiem ar Al 3+seko skaidrai noteikumu kopai: kopējai pozitīvajai zīmei jāizlīdzina kopējā negatīvā zīme. Tā ir jonu savienojumu lādiņa izlīdzināšana. Apskatīsim, kā apvienot alumīnija lādiņa ions ar dažiem no visbiežāk sastopamajiem anjoniem, tostarp ar poliatomiskiem, piemēram, fosfāta jona lādiņš , acetāta jona lādiņš , un nitrāta lādiņš :
| Formūla | Sastāvdaļu joni | Vārds | Lādiņu bilances piezīmes |
|---|---|---|---|
| Al 2O 3 | 2 Al 3+, 3 O 2− | Aluminija oksīds | 2×(+3) + 3×(−2) = 0 |
| AlCl 3 | 1 Al 3+, 3 Cl − | Alumīnija hlorīds | 1×(+3) + 3×(−1) = 0 |
| Al 2(SO 4)3 | 2 Al 3+, 3 SO 42− | Aluminium sulfātu | 2×(+3) + 3×(−2) = 0 |
| Al(NO 3)3 | 1 Al 3+, 3 NO 3− | Alumīnija nitrāts | 1×(+3) + 3×(−1) = 0 |
| Al(C 2Augstums 3O 2)3 | 1 Al 3+, 3 C 2Augstums 3O 2− | Alumīnija acetāts | 1×(+3) + 3×(−1) = 0 |
| AlPO 4 | 1 Al 3+, 1 PO 43− | Alumīnija fosfāts | 1×(+3) + 1×(−3) = 0 |
Ievērojiet, kā indeksi tiek izvēlēti tā, lai pozitīvo un negatīvo lādiņu summa būtu nulle. Jaundzīmīgajiem joniem, ja nepieciešami vairāki, pirms indeksa pievienošanas vienmēr iekavās ierakstiet jonu (piemēram, Al(NO 3)3).
Kad iekļaut romiešu ciparus
Kopš jonu nosaukums alumīnijam ir nepārprotams, bieži vien redzēsiet „alumīnija jons” bez romiešu cipara. Tomēr dažas mācību grāmatas vai atsauces var joprojām izmantot „alumīnijs(III)”, lai uzsvērtu +3 lādiņu, īpaši kontekstos, kur citiem elementiem ir iespējami vairāki oksidēšanās pakāpes. Ar alumīniju tas ir galvenokārt stilistisks izvēles jautājums—ne nepieciešamība (skatīt avotu) .
- Aizmirst izmantot iekavas ap poliatomiskajiem joniem, kad tos ir vairāk nekā viens, piemēram, rakstot AlNO 33nevis Al(NO 3)3
- Kļūdaini aprēķināt kopējo lādiņu un iegūt neizlīdzinātu formulu
- Jaukties poliatomisko jonu lādiņos, piemēram, fosfāta jona lādiņš (−3), acetāta jona lādiņš (−1), vai nitrāta lādiņš (−1)
Pirmā lieta: Vienmēr līdzsvarojiet kopējo pozitīvo un negatīvo lādiņu — izmantojiet zemāko veselo skaitļu attiecību formulu un divreiz pārbaudiet poliatomu jonu lādiņus un iekavas.
Apbruņojies ar šiem noteikumiem un piemēriem, tu ātri vien spēsi uzrakstīt un nosaukt jebkuru alumīniju saturošu jonu savienojumu ar pārliecību. Nākamajā solī, redziet, kā šie nosaukšanas modeļi saistīti ar alumīnija jonu reālās pasaules ietekmi materiālos un pabeigšanas procesos.

Reālās pasaules ietekme Al 3+Materiālos un pabeigšanā
No Al 3+līdz oksīda plēvēm un anodēšanai
Kad domājat par alumīnija detaļu izturību un veiktspēju, alumīnija jonu lādiņš ir vairāk nekā tikai mācību grāmatas jēdziens — tā ir pamats tam, kā alumīnijs uzvedas reālās pasaules vidē. Vai jūs esat pamanījis, kā alumīnija virsmas attīsta plānu aizsargājošu slāni gandrīz uzreiz? Tas ir rezultāts Al 3+joni reaģē ar skābekli, veidojot stabilu oksīda plēvi. Šī dabiskā pasivācija aizsargā pamatmetālu no turpmākas korozijas un ir galvenais iemesls, kāpēc alumīnijs tik plaši tiek izmantots inženierijā un ražošanā.
Bet kas notiek, ja nepieciešama patiesspēcīgāka aizsardzība vai noteikta virsmas apdare? Tieši šeit nāk palīgā anodēšana anodēšana. Anodēšana ir kontrolēts elektroķīmisks process, kas apzināti palielina oksīda slāņa biezumu, izmantojot ārēju strāvu, lai veidotu hidratētu alumīnija oksīdu. Šis process balstās uz kustību un pārveidošanos jonu alumīnijs virsmā — jo lielāka alumīnija tieksme eksistēt kā Al 3+, jo izturīgāka ir iegūtā oksīda plēve (atsauce) .
- Al 3+joni pārvietojas uz virsmu, pielietojot spriegumu
- Tie reaģē ar ūdeni un skābekli, veidojot blīvu, aizsargājošu oksīdu
- Šis inženiertehniskais slānis iztur koroziju, abraziju un vides nodilumu
Iedomājieties, ka projektējat automašīnas daļu, kas pakļauta ceļa sāļu, mitruma vai augstām temperatūrām – bez šī jonu vadītā oksīda barjeras, daļa ātri noveco. Tāpēc izpratne par kāds lādiņš ir alumīnijam nav vienkārši ķīmijas fakts, bet gan praktiska dizaina problēma.
Projektēšanas ietekme uz izstrādātiem alumīnija izstrādājumiem
Tagad savienosim punktus ar ekstrūziju un pabeigšanu. Kad norādāt alumīnija sakausējumu vai izstrādājuma formu kritiskai lietošanai, jūs ne tikai ņemat vērā formu vai izturību – jūs arī domājat par to, kā virsma izturēsies reālos apstākļos. Al tendence 3+veidot stabilu oksīdu nozīmē, ka izstrādātus izstrādājumus var pielāgot ar dažādu veidu anodiskām plēvēm, no kurām katra piedāvā unikālu veiktspēju:
- Materiāla klase: Sakausējuma sastāvs ietekmē oksīda veidošanos un korozijas izturību
- Virsmas apstrāde: Tips I (hromskābe), Tips II (caurspīdīgs pārklājs) un Tips III (cietā anodēšana) pabeigšana piedāvā dažādu izturību un izskatu
- Tolerances kontrole: Anodēšanu var izstrādāt, lai uzturētu precīzas dimensijas augstas veiktspējas detaļām
- Alumīnija polarizācija: Virsmas lādiņa un oksīda biezuma kontroles iespēja ir kritiska lietojumiem, kuriem nepieciešama elektriskā izolācija vai vadītspēja
Automobiļu, aviācijas vai arhitektūras lietošanai, pareiza sakausējuma un virsmas apdarei ir jābūt pamatotai ar alumīnija jonu lādiņš —nodrošina, ka komponents kalpos ilgi, izskatīsies labi un veiks paredzētās funkcijas. Vēl joprojām brīnāties: "vai alumīnijs piešķir vai zaudē elektronus"? Visos šajos procesos alumīnijs zaudē elektronus, lai veidotu kationu, kas nodrošina visa oksidēšanās un aizsardzības ciklu.
Piegādātāji, kuri saprot jonu uzvedību virsmas apdare
Izvēloties piegādātāju, kurš patiesi saprot ķīmiju, kas stāv aiz alumīnija kationa vai aniona pārveidošanas, var izlemt jūsu projekta panākumus vai neveiksmi. Zemāk ir risinājumu piegādātāju salīdzinājums attiecībā uz ekstrudētām alumīnija detaļām, koncentrējoties uz viņu ekspertīzi virsmas apdare un kvalitātes kontroli:
| Piedāvātājs | Virsmas apdares ekspertīze | Kvalitātes prakse | Pakalpojumu apjoms |
|---|---|---|---|
| Shaoyi (alumīnija profila daļas) | Uzlabota anodēšana, precīza oksīda kontrole, automobiļu klases virsmas inženierija | Sertificēts pēc IATF 16949, pilna procesa izsekojamība, DFM/SPC/CPK kritiskām dimensijām | Vesela risinājuma pakalpojums: dizains, prototipu izstrāde, masveida ražošana, piegāde visā pasaulē |
| Fonnov Aluminium | Individuāla anodēšana, pulvera pārklājums, arhitektūras un inženierizstrādes pabeigšana | Atbilstība valsts un starptautiskajiem standartiem, kvalitātes prioritāte | Dizains, ekstrūzija, izgatavošana, pabeigšana dažādām nozarēm |
Izvērtējot partneri, ņemiet vērā:
- Materiālu klases un sakausējumu izvēle jūsu pielietojumam
- Ekspertīze virsmas apstrādē (anodēšana, pulvera pārklājums utt.)
- Spēja izpildīt ciešas pielaidi un kritiskus virsmas nosacījumus
- Kvalitātes sertifikāti un procesu pārredzamība
- Pieredze ar korozijas mazināšanu un oksīda plēves inženieriju
Galvenais: Al 3+lādiņa stāvoklis ir dzinējs, kas nodrošina alumīnija korozijizturību un virsmas kvalitāti. Sadarbojoties ar piegādātāju, kurš katrā posmā pārvalda šo ķīmiju, jūsu komponenti būs izturīgāki un labāk veiktspējīgi.
Izprotot alumīnija jonu lādiņš lomas virsmas inženierijā, jūs būsiet labāk sagatavoti specifikācijai, iepirkšanai un augstas veiktspējas alumīnija detaļu uzturēšanai. Nākamajā posmā uzziniet par praktiskiem rīkiem un darba plūsmām, lai paredzētu un piemērotu šos lādiņa principus savos projektos.
Rīki un darba plūsmas, lai precīzi prognozētu lādiņus
Izveidojiet uzticamu lādiņa prognozēšanas darba plūsmu
Vai jūs esat skatījies uz ķīmisko formulu un brīnījies: "Kā es zinu, kāds lādiņš ir katram elementam – īpaši alumīnijam?" Jūs neesat viens. Pareizi noteikt jonu lādiņu var šķist pārslodze, bet ar labi marķētu periodisko elementu tabulu ar lādiņiem un dažiem gudriem ieradumiem jūs to apgūsiet ātri. Triks ir izmantot periodisko tabulu kā savu pirmo atskaites punktu, pēc tam apstiprinot detaļas daudzatomu joniem un īpašiem gadījumiem, kā jūs ejat.
| Grupa | Bieži sastopams lādiņš |
|---|---|
| 1 (Lūžņu metāli) | +1 |
| 2 (Zemes sārmu metāli) | +2 |
| 13 (Alumīnija grupa) | +3 |
| 16 (Chalkogēni) | −2 |
| 17 (halogēni) | −1 |
Šī vienkāršā tabula atspoguļo izkārtojumu, ko jūs redzēsiet liumāžām no periodiskās tabulas ar lādiņu diagrammām. Alumīnijam vienmēr jābūt +3 – padarot to par vienu no prognozējamākajiem katjonu periodiskajā tabulā.
Izmantojiet grupu tendences un apstipriniet poliatomāros jonus
Kad būsiet gatavs risināt sarežģītākas formulas, neuzsveriet tikai atmiņu. periodiskā tabula ar kationiem un anioniem ir jūsu draugs galvenās grupas elementiem, taču poliatomāriem joniem ir nepieciešams apstiprināts saraksts. Šeit ir daži no visbiežāk sastopamajiem kopīgi joni ar kuriem lādiņiem:
| Vārds | Formūla | Uzlāde |
|---|---|---|
| Nitrāts | Nē 3− | −1 |
| Sults | Tāpēc 42− | −2 |
| Fosfāts | PO 43− | −3 |
| Acetāts | C 2Augstums 3O 2− | −1 |
| Hidroksīds | OH − | −1 |
| Karbons | Co 32− | −2 |
| AMONIJS | NH 4+ | +1 |
Turiet pieejamu izdrukājamu šo jonu lapu, kad strādājat pie uzdevumiem vai rakstāt laboratorijas ziņojumus. Pilnīgākam sarakstam apskatiet šo poliatomāro jonu atsauce .
Ātri un pareizi uzrakstiet līdzsvarotas formulas
Kad zināt lādiņus, pareizu formulu rakstīšana ir līdzsvarota kopējā pozitīvā un negatīvā lādiņa summa, kas summā ir nulle. Šeit ir ātra darba kārtība, lai to izdarītu pareizi:
- Atrodiet katru elementu vai jonu uz elementu periodiskās tabulas un lādiņiem vai jūsu poliatomāro jonu saraksta.
- Uzrakstiet jonu simbolus ar to lādiņiem (piemēram, Al 3+, SULFĪRS 42−).
- Nosakiet zemāko jonu attiecību, kas balansē lādiņus līdz nullei.
- Uzrakstiet empīrisko formulu, izmantojot iekavas poliatomāriem joniem, ja nepieciešami vairāk nekā viens (piemēram, Al 2(SO 4)3).
- Pārbaudiet darbu vēlreiz: vai lādiņu summa ir vienāda ar nulli?
Mnemonika: "Al vienmēr tiecas uz +3—izmantojiet tabulu, izlīdziniet lādiņu, un jūs nekad nekļūdīsieties."
Ievērojot šo procesu un izmantojot periodiskās tabulas ar lādiņu kā savu balstu, jūs paātrināsiet mājasdarbus, laboratorijas sagatavošanos un pat eksāmenu uzdevumu risināšanu. Atcerieties: Al kāda ir alvas lādiņa atbilde ir +3—katrreiz, izņemot gadījumus, kad skaidri norādīta reta izņēmuma kļūda.
Ar šiem praktiskajiem rīkiem un darbplūsmām jūs pāriesiet no fakto iegaumēšanas uz patiesu izpratni par lādiņiem periodiskajā tabulā—un būsiet gatavi jebkurai nosaukšanas vai formulas izveides problēmai, kas seko.
Sintēze un nākamie soļi drošai Al izmantošanai 3+
Galvenie secinājumi par Al 3+jūs varat paļauties
Kad jūs atkāpjas un raugās uz lielā ainas kopumā, prognozēšana kļūst par vienkāršu un uzticamu procesu. Še iemesls: al jonu lādiņš kļūst par vienkāršu un uzticamu procesu. Še iemesls:
- Periodiskās tabulas loģika: Alumīnija vieta 13. grupā nozīmē, ka tas gandrīz vienmēr veido +3 lādētu jonu. Ja jums kādreiz rodas šaubas par kāda ir alumīnija lādiņa , atcerieties, ka šīs grupas tendence ir jūsu īsceļš uz pareizo atbildi.
- Elektronu konfigurācija: Zaudējot trīs vērtības elektronus, alumīnijs sasniedz retgāzu kodolu – padarot Al 3+par visstabilāko un izplatītāko stāvokli. Tā ir atbilde uz jautājumu „ kādu jonu veido alumīnijs ?”
- Paredzama ķīmija: Vai nu jūs līdzsvarojat formulas, nosaucat savienojumus vai apsverat koroziju, jūs varat paļauties uz Al 3+kā noklusējumu alumīnija jona lādiņš .
- Alumīnijs gandrīz vienmēr veido +3 kationu — paredzamu, stabila un viegli atpazīstamu.
- Al 3+virza ūdens ķīmiju, savienojumu veidošanos un korozijizturību.
- Šī lādiņa apguve palīdz jums risināt reālas problēmas dizainā, iepirkšanā un problēmrisināšanā.
Kur vēl piemērot šīs zināšanas
Tātad, kā zināšana par al lādiņu palīdz jums ārpus klases? Iedomājieties, ka jūs esat:
- Ūdens attīrīšanas procesa projektēšana—izpratne par Al 3+hidrolīze ļauj kontrolēt nogulšņu veidošanos un šķīdību.
- Ķīmisko formulu rakstīšana—Al 3+ir jūsu balasta lādiņš, balansējot ar kopīgiem anjoniem.
- Specificēšana vai ekstrudētu alumīnija detaļu iegāde—zināšana par kāda ir alumīnija veidotā jona lādiņa palīdz izprast, kāpēc veidojas oksīda plēves un kā anodēšana aizsargā jūsu komponentus.
Ja jums kādreiz rodas šaubas, vienkārši jautājiet sev: Vai alumīnijs šajā kontekstā ir kations vai anjons? Atbilde gandrīz vienmēr ir kations (Al 3+), un šī skaidrība paātrinās jūsu darbu—vai nu gatavojoties pārbaudei, vai projektējot jaunu produktu.
| Koncepcija | Piemērs | PIEKTAIS |
|---|---|---|
| 13. grupas pozīcija | Al veido Al 3+ | Ātra lādēšana prognozē |
| Elektronu zudums līdz [Ne] | Al: [Ne]3s 23P 1→ Al 3+: [Ne] | Izskaidro stabilitāti |
| Al 3+ūdenī | [Al(H 2O) 6]3+sarežģīti | Šķīdinātā veidā notiekoša ķīmiskā reakcija, hidrolīze |
| Oksīda plēves veidošanās | Al 3++ O 2−→ Al 2O 3 | Korozijizturība, anodēšana |
Ieteicamie resursi praktizēšanai un iegādei
Gatavs pielietot savas zināšanas praksē? Šeit ir tālākā darbība:
- Shaoyi (alumīnija profila daļas) – Inženieriem un dizaineriem, kas meklē augstas veiktspējas, korozijizturīgas izstieptas alumīnija detaļas, Shaoyi izceļas ar savu ekspertīzi anodēšanā, oksīda plēvju inženierijā un automašīnu klases pabeigšanā. Viņu izpratne par alumīnija jonu uzvedību nodrošina labākas un ilgāk izturīgas detaļas.
- 13. grupas ķīmijas rokasgrāmata – Dziļāk izpētiet periodiskās tendences, grupas izņēmumus un lādiņu loģiku kontekstā.
- Periodiskā tabula ar lādiņiem – Drukājama atsauce ātrai lādiņa noteikšanai un formulējumu rakstīšanai.
Vai nu mācoties ķīmijas eksāmenam vai norādot materiālus jaunam produktam, izprotot kāds ir alumīnija lādiņš ir prasmi, ko izmantosiet atkal un atkal. Un, kad nepieciešami komponenti, kuru izturība ir maksimāli izstrādāta, apspriedieties ar piegādātāju, piemēram, Shaoyi, kas saprot zinātni, kas slēpjas aiz katras virsmas.
Al Jonu lādiņš: Bieži uzdotie jautājumi
1. Kāds ir alumīnija jonu lādiņš un kāpēc veidojas Al3+?
Alumīnijs gandrīz vienmēr veido +3 jonu lādiņu, jo zaudē trīs vērtības elektronus, lai sasniegtu stabila nejauša gāzes konfigurāciju. Tādēļ Al3+ ir visizplatītākais un stabils ions, kas atrodams savienojumos, kas vienkāršo lādiņa paredzēšanu un formulas rakstīšanu.
2. Kā ātri paredzēt alumīnija lādiņu, izmantojot periodisko tabulu?
Lai paredzētu alumīnija lādiņu, atrodiet to 13. grupā periodiskajā tabulā. Galvenās grupas elementi šajā grupā parasti veido +3 kationus, tāpēc alumīnija lādiņš ir uzticami +3. Šī grupas tendence palīdz jums prognozēt lādiņus, nepamatojoties uz atmiņu par katru elementu atsevišķi.
3. Kāpēc alumīnija +3 lādiņš ir svarīgs reālās pasaules lietojumos, piemēram, anodēšanā?
Alumīnija +3 lādiņš ļauj veidoties stabilai oksīda kārtai uz tā virsmas, kas ir būtiska korozijizturībai un izturībai. Šī īpašība ir kritiska procesos, piemēram, anodēšanā, kur oksīda kārta apzināti tiek pabezīta, lai aizsargātu un uzlabotu alumīnija detaļas, kas tiek izmantotas nozarēs, piemēram, automašīnu ražošanā.
4. Kā alumīnija jonu lādiņš ietekmē tā uzvedību ūdenī un savienojumos?
Ūdenī Al3+ veido kompleksus ar ūdens molekulām un pakļaujas hidrolīzei, veidojot dažādus alumīnija jonus atkarībā no pH. Tā stiprais lādiņš arī veicina stabila jonu savienojumu veidošanos, kuru paredzamās formulas balstās uz lādiņa izlīdzināšanu ar kopīgiem anjoniem.
5. Ko man vajadzētu ņemt vērā, iegādājoties alumīnija detaļas projektos, kas ietver jonu ķīmiju?
Izvēlieties piegādātājus, kuriem ir ekspertīze alumīnija jonu uzvedībā un advanced virsmas apstrādē. Piemēram, Shaoyi piedāvā integrētas alumīnija ekstrūzijas risinājumus, nodrošinot, ka komponentiem ir optimizēta virsmas ķīmija un izturība, pateicoties precīzai kontrolei pār anodēšanu un oksīda plēves veidošanos.
 Mažas partijas, augsti standarti. Mūsu ātra prototipēšanas pakalpojums padara validāciju ātrāku un vieglāku —
Mažas partijas, augsti standarti. Mūsu ātra prototipēšanas pakalpojums padara validāciju ātrāku un vieglāku —
